მშობლების მოთხოვნა
საქართველოში ბოლო კვირების განმავლობაში აქონდროპლაზიის მქონე ბავშვების მშობლებმა საზოგადოების განსაკუთრებული ყურადღება მიიქციეს - ისინი აქციებს ატარებდნენ და სახელმწიფოსგან ჯანმრთელობის ამ მდგომარეობის წამლის - "ვოზორიტიდის" შემოტანასა და დაფინანსებას სთხოვდნენ, შვილების ცხოვრების ხარისხის გასაუმჯობესებლად.
5 მაისს მათ აქცია შეწყვიტეს, რადგან, მათივე თქმით, ჯანდაცვის სამინისტროსგან მიიღებს პირობა, რომ აქონდროპლაზიის კლინიკური მართვის ეროვნული პროტოკოლი, სადაც ინტერვენცია ამ წამალთან დაკავშირებითაც იქნება გათვალისწინებული, მზად იქნება ამ თვის ბოლოს. მშობლებმა ფინანსთა სამინისტროდან ბიუჯეტის გამოყოფის პირობაც მიიღეს.
წამლის შესყიდვის [პირდაპირი, საერთაშორისო ტენდერ[ებ]ით, სხვ.] და სხვა პროცედურების ბიუჯეტი ჯერ გაწერილი არ არის.
მონაცემები "ვოზორიტიდზე"
აქონდროპლაზიის წამალ ვოზორიტიდზე, რომლის შემოტანასაც ჯანმრთელობის ამ მდგომარეობის მქონე ბავშვების მშობლები ითხოვენ, სამი კლინიკური კვლევაა დასრულებული, ხოლო ხუთი - ამჟამადაც მიმდინარეობს, სხვადასხვა ასაკობრივ ჯგუფში, მათ შორის, მოზრდილებშიც [18+ ადამიანებში]
მიუხედავად იმისა, რომ ვოზორიტიდი უკვე არის დამტკიცებული მსოფლიოში ყველაზე გავლენიანი მარეგულირებლის - ა.შ.შ. სურსათისა და წამლის ადმინისტრაციის [US Food and Drug Administration, F.D.A] მიერ, ერთი, კარგი ხარისხის კლინიკური კვლევის საფუძველზე, მაინც არსებობს კითხვები ვოზორიტიდის უსაფრთხოებასა და ეფექტურობაზე.
შესაბამისად, კვლევები გრძელდება როგორც ამერიკის ორივე კონტინენტზე, ასევე ევროპასა და აზიაში.
თავდაპირველად, 2021 წლის ბოლოს, ა.შ.შ. სამედიცინო მარეგულირებელმა, მწირი მონაცემების მიუხედავად, ვოზორიტიდი იმიტომ დაუშვა, რომ ამ წამლის ღირებულებისა და სარგებლიანობის [cost-benefit ratio] აწონ-დაწონვის შეფასებისას, F.D.A.-ის საკონსულტაციო საბჭოს აზრით, მისმა სარგებლიანობამ გადააჭარბა რისკებს, საშუალო დონის კლინიკური წარმატებისა და ყურადსაღები გვერდითი მოვლენ[ებ]ის მიუხედავად.
მოკლე ისტორია
აქონდროპლაზია იშვიათი და რთული დაავადება. იგი პაციენტის სიცოცხლის განმავლობაში პროგრესირებს, გავლენას ახდენს ორგანიზმის სხვადასხვა სისტემაზე, იწვევს გართულებებს და აისახება ცხოვრების ხარისხზე.
დამიზნებითი [თარგეთული] სამკურნალო მედიკამენტ[ებ]ი ჯანმრთელობის ამ მდგომარეობაზე არ არსებობს. ამიტომ დაავადების მართვა დღემდე მიმართულია სიმპტომებისა და გართულებების კორექციაზე, მათ შორის, სიმპტომებზე მოქმედი მედიკამენტებით.
ვოსორიტიდი არის პირველი ავტორიზებული წამალი, რომელიც მიზნობრივად მოქმედებს აქონდროპლაზიის გამომწვევ მიზეზზე. პრეპარატმა ორფანული [ობოლი] წამლის სტატუსი 2013 წელს მიიღო. ამით მის მწარმოებელ კომპანიას მიეცა შესაძლებელობა, არასრული კვლევებით, წამალზე მარკეტინგული ავტორიზაციის განაცხადი წარედგენა.
2021 წლის აგვისტოში ევროპის მარეგულირებელმა E.M.A.-მ პრეპარატს მარკეტინგული ავტორიზაცია მიანიჭა და შესაძლებელი გახადა მასზე ადრეული წვდომა. ორფანული წამლების ავტორიზაცია [orphan designation] ევროკავშირში ხორციელდება მხოლოდ ცენტრალიზებულად, რაც ითვალისწინებს პრეპარატის ერთდროულ დაშვებას ევროკავშირის ყველა ქვეყანაში.
ავტორიზაცია განხორციელდა 1 ჩვენებით: აქონდროპლაზიის სამკურნალოდ 2 წელზე უფროსი ასაკის პაციენტებში, რომელთა ეპიფიზი არ არის დახურული. აქონდროპლაზიის დიაგნოზი უნდა დადასტურებული იყოს გენეტიკური კვლევებით; წინსწრებით დამტკიცდა ვოსორიტიდის განვითარების კლინიკური გეგმა, რომელიც ინტერვენციული კლინიკური კვლევების ნაწილში ითვალისწინებს ჯამში 8 კვლევას.
ამ ეტაპზე მხოლოდ 3 კვლევაა დასრულებული, რაც გახდა კიდეც ავტორიზაციის საფუძველი, ვინაიდან მონაცემები, რისკი/სარგებლის ბალანსით [cost-benefit ratio], კეთილსაიმედოა.
საყურადღებოა, რომ კვლევა ჩატარდა შეზღუდული რაოდენობა ინდივიდებზე და კვლევაში ჩართვის ძალიან მკაცრი შეზღუდვის კრიტერიუმებით, შესაბამისად არსებული მონაცემების ექსტრაპოლაცია შეუძლებელია, მით უფრო გრძელვადიან პერსპექტივაში. საჭიროა მეტი მონაცემები, ნაკლები შეზღუდვის პირობებში და გაცილებით ხანგრძლივი პერიოდის განმავლობაში.
"ვოზორიტიდი" ჯერ არ არის ჯანდაცვის მსოფლიო ორგანიზაციის “სასიცოცხლოდ აუცილებელი მედიკამენტების ნუსხაში”. ამ სიაში წამლის შეტანა გაცილებით მაღალი ხარისხის მტკიცებულებებს მოითხოვს.
ჯანდაცვის მსოფლიო ორგანიზაცია არ ზღუდავს არც ერთ ქვეყანას წამლის ეროვნულად დაშვებასთან დაკავშირებით: ყველას დამოუკიდებლად შეუძლია გადაწყვეტილების მიღება, მაგრამ, მწირი მონაცემების გამო, სახელმწიფოების პასუხისმგებლობის წილი ძალიან მაღალია.
რამდენ ბავშვს ეხება საქართველოში?
საქართველოს დაავადებათა კონტროლისა და საზოგადოებრივი ჯანმრთელობის ეროვნული ცენტრის [NCDC] ინფორმაციით, საქართველოში აქონდროპლაზიის მდგომარეობის 10 ახალი შემთხვევა გამოვლინდა 2020 წლიდან დღემდე [WHO-ს სტანდარტით და სიზუსტით დათვლილი უფრო ძველი მონაცემი NCDC-ს არ აქვს].
აქონდროპლაზიის მდგომარეობით მყოფი ბავშვებიდან საქართველოში ყველაზე პატარა ასაკის ბავშვი ერთ წლამდე ბიჭია, ხოლო ყველაზე უფროსი - 17 წლის მოზარდი.
შემთხვევათა უმეტესობა [7 ახალი შემთხვევა] თბილისში გამოვლინდა, სამი დანარჩენი - აჭარაში, იმერეთსა და შიდა ქართლში.
მიუხედავად იმისა, რომ ვოზორიტიდი, დაჩქარებული წესით, უკვე არის დამტკიცებული მსოფლიოში ყველაზე გავლენიანი მარეგულირებლის - ა.შ.შ. სურსათისა და წამლის ადმინისტრაციის [US Food and Drug Administration, F.D.A] მიერ, მაინც არსებობს კითხვები ვოზორიტიდის უსაფრთხოებასა და ეფექტურობაზე. შესაბამისად, კვლევები ამ და სხვა შედეგების გასაგებად გრძელდება როგორც ამერიკის ორივე კონტინენტზე, ასევე ევროპასა და აზიაში.
2021 წლის ბოლოს, ა.შ.შ. სამედიცინო მარეგულირებელმა, მწირი მონაცემების მიუხედავად, ვოზორიტიდი იმიტომ დაუშვა, რომ ამ წამლის ღირებულებისა და სარგებლიანობის [cost-benefit ratio] აწონ-დაწონვის შეფასებისას, F.D.A.-ის საკონსულტაციო საბჭოს აზრით, მისმა სარგებლიანობამ გადააჭარბა რისკებს, კლინიკური კვლევების შუალედური სამიზნეების დაკმაყოფილების [intermediate clinical endpoint] ფონზე და ყურადსაღები გვერდითი მოვლენ[ებ]ის მიუხედავად.
რა არის აქონდროპლაზია?
აქონდროპლაზია [რომელსაც ავადმყოფობათა და ჯანმრთელობასთან დაკავშირებული პრობლემების საერთაშორისო სტატისტიკურ კლასიფიკაციაში [ICD 10] დიაგნოზს „აქონდროპლაზია“ მინიჭებული აქვს კოდი Q77.4.] გენეტიკური მდგომარეობაა, რომლის დროსაც მოზრდილი ადამიანი საშუალოზე დაბალია, ხოლო ბავშვის ზრდის ტენდენცია - შეჩერებული ან/და არაპროპორციული. აქონდროპლაზის მდგომარეობის მქონე ზრდასრული ინდივიდის სიმაღლე, საშუალოდ, 121 სანტიმეტრია.
აქონდროპლაზის დიაგნოზის მქონე ადამიანები გენეტიკურ მუტაციას ატარებენ, რომლის დროსაც ზრდის მარეგულირებელი გენი - ფიბრობლასტური ზრდის ფაქტორის რეცეპტორი 3 - განსაკუთრებით აქტიურია და ძვლის ნორმალურ ზრდა-განვითარებას ხელს უშლის - მყიფე ხრტილის მყარ ძვლად გადაქცევა ვერ ხდება.
ძვლის არაპროპორციული ზრდის გარდა, აქონდროპლაზიას ახასიათებს ჯანმრთელობის სერიოზული გართულებები [ხერხემლის კომპრესია, ძილის აშლილობები, შუა ყურის მწვავე ანთება [ოტიტი], სმენის დაქვეითება, კიფოსქოლიოზი, ზურგის სტენოზი].
სხეულის სტრუქტურის ასეთი დარღვევები ადამიანს ხელს უშლის სოციალურ ცხოვრებაში, ყოველდღიურ საქმიანობაში, გადაადგილებაში, საკუთარი თავის მოვლაში და აკადემიურ მოსწრებაში.
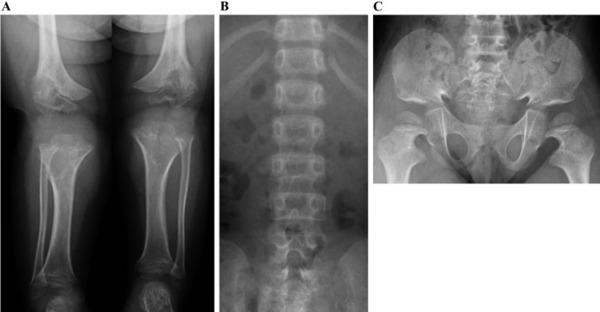
აქონდროპლაზიის მქონე ბავშვის ქვედა კიდურების, ხერხემლისა და მენჯის რენტგენი; წყარო - იაპონელი ექიმების აკადემიური რჩევები აქონდროპლაზიის მართვაზე - Clinical Practice Guidelines for Achondroplasia
“ვოქსზოგო” [ვოზორიტიდი]
აქონდროპლაზიის მსოფლიოში ერთადერთი დაშვებული წამალი - “ვოქსზოგო” [ვოზორიტიდი], რომელსაც მსოფლიოში ერთადერთი ამერიკული კომპანია BioMarin აწარმოებს, ამერიკის შეერთებული შტატების მარეგულირებელმა - სურსათისა და წამლის ადმინისტრაციამ [Food and Drug Administration, FDA] 2021 წლის 19 ნოემბერს დაუშვა, 5 წლისა და უფროსი ასაკის აქონდროპლაზიისა და ღია ეპიფეზის მქონე, ანუ ისეთი მდგომარეობის მქონე ინდივიდებისთვის, რომლებსაც [ძვლოვანი სისტემის და კიდურების] ზრდის პოტენციალი აქვთ.
F.D.A.-ის ინფორმაციით, დამტკიცების დროს, ვოქსზოგოს უსაფრთხოება და ეფექტურობა ზრდასთან მიმართებით გაიზომა ორმაგად ბრმა, პლაცებოთი გაკონტროლებული, 3-ფაზიანი კლინიკური კვლევით, რომელიც ერთი წელი მიმდინარეობდა. კვლევაში მონაწილეობდნენ 5 წლისა და უფროსი ასაკის ინდივიდები, რომლებსაც ჰქონდათ აქონდროპლაზია, ღია ეპიფეზით, რომლის ფარგლებშიც 121 ინდივიდს, შემთხვევითი შერჩევის პრინციპით, მისცეს ვოქსზოგოს ინექცია კანქვეშ, ხოლო საკონტროლო ჯგუფს - პლაცებო.
მკვლევარებმა კვლევაში მონაწილე ინდივიდების ზრდის საშუალო წლიური სიჩქარე, ანუ ზრდის მაჩვენებელი, წლის ბოლოს გაზომეს. მონაწილეები, რომლებმაც ვოქსზოგო მიიღეს, საშუალოდ 1.57 სანტიმეტრით უფრო მეტად გაიზარდნენ, ვიდრე ისინი, ვინც პლაცებო მიიღო.
ვოქსზოგოს ყველაზე ხშირი გვერდითი მოვლენები იყო კანზე მცირე ალერგიული რეაქცია ინექციის ადგილას, გულისრევა და სისხლის წნევის დაცემა. შესაბამისად, ვოქსზოგოს ანოტაციაში წერია, რომ მისი მნიშვნელოვანი გვერდითი მოვლენა სისხლის წნევის ვარდნაა, რაც, FDA-ის საბჭოს მოსაზრებით, სერიოზული გვერდითი ეფექტია, რაც გულზეც ახდენს გავლენას [რომელიც ადამიანის ერთ-ერთი სასიცოცხლო ორგანოა ხუთიდან].
ვოქსზოგო პაციენტს ეძლევა ინექციის სახით, დღეში ერთხელ, სასურველია, დღის ერთსა და იმავე პერიოდში. ინექციის ადგილი სულ უნდა იცვლებოდეს. დოზა ითვლება პაციენტის სხეულის წონის მიხედვით. თითო კილოგრამზე რეკომენდებულია 15 მიკროგრამი ვოქსზოგო, დღიურად.
მკურნალობა მას მერე უნდა დაიწყოს, რაც აქონდროპლაზია გენეტიკური ანალიზით დამტკიცდება და უნდა შეწყდეს მაშინ, როცა ძვლოვანი სისტემა ზრდას აღარ/ვეღარ აგრძელებს.
რა რეჟიმში დამტკიცდა Voxzogo?
F.D.A.-ს ფარმაცევტული საშუალებებისა და სამედიცინო ტექნოლოგიების დამტკიცების სხვადასხვა რეჟიმი აქვს.
მაგალითად, COVID-19 ვაქცინები, პანდემიის გამო, “საგანგებო/გადაუდებელი გამოყენების” [Emergency Use Authorization, EUA] რეჟიმით დამტკიცდა, თუმცა, დამტკიცების მომენტში ვაქცინებს ყველა საჭირო [სამივე] ფაზა ჰქონდათ გავლილი ადამიანებში.
Voxzogo F.D.A.-მ დაჩქარებული წესით [accelerated approval] დაამტკიცა, რაც ზემოთ სხენებული რეჟიმისგან განსხვავდება. ასეთი რეჟიმი ნიშნავს წამლის დამტკიცებას იმიტომ, რომ არსებობს ჯანმრთელობის სერიოზული მდგომარეობა, რომელზეც არ არსებობს სხვა ან/და უფრო ეფექტური სამკურნალო საშუალება, არსებული სამედიცინო მოთხოვნილება დაუკმაყოფილებელია და მართალია, წამალი ძალიან წარმატებული არ არის კლინიკურ-სტატისტიკურად, მაგრამ აკმაყოფილებს კლინიკური კვლევის შუალედურ მიზნებს [intermediate clinical endpoint].
წამლის აპლიკაცია F.D.A.-ს შესაბამისმა საბჭომ ასევე “პრიორიტეტულად განიხილა” [იგულისხმება F.D.A.-ს ექსპერტთა დამოუკიდებელი საბჭო, რომელსაც მარეგულირებელი ყოველ ჯერზე ირჩევს და იწვევს კონკრეტული წამლის გამოცდის შედეგების შესაფასებლად. წამლის დამტკიცებამდე საბჭო კომპანიის წარდგენილი კლინიკური კვლევების შედეგებს განიხილავს, რაც აუცილებლად მოიცავს სტატისტიკურ ნაწილს და მისი ერთ-ერთი ყველაზე მნიშვნელოვანი ნაწილია, წარმატების შედეგების დათვლის თვალსაზრისით. საბჭო შედგება სფეროს ყველაზე გამოცდილი და დამოუკიდებელი სპეციალისტებისგან, რომლებსაც იმ კონკრეტულ ფარმაცევტულ კომპანიასთან ინტერესთა კონფლიქტი არ აქვთ. საბჭო იცვლება, სფეროების მიხედვით. კლინიკური კვლევების გაცნობის შემდეგ, საბჭოს წევრები ხმას აძლევენ წამლის დამტკიცება-არდამტკიცების პროცედურას. საბოლოო გადაწყვეტილების მიღების დროს, F.D.A. არაა ვალდებული, ექსპერტების აზრი გაიზიაროს, თუმცა, უმეტეს შემთხვევებში, იზიარებს ხოლმე.]
კომპანიის ვალდებულება და ნებართვის აუცილებელი დათქმა
წამლის ბაზარზე ჩაშვების მიუხედავად, კომპანიას აქვს ვალდებულება, გააგრძელოს და ჩაატაროს სხვადასხვა დიზაინის, გაკონტროლებული კლინიკური კვლევები 5 წელს ზემოთ ასაკის პაციენტებში, რომელთა ეპიფეზი დახურული არ არის, რათა გაიზომოს ვოზორიტიდის ეფექტურობა სიმაღლის ზრდასთან დაკავშირებით.
მომავალმა კლინიკურმა კვლევებმა მეორად სამიზნეებში [secondary endpoint] ასევე უნდა ჩადონ ძვლის დისპროპორციულად ზრდის რისკების კონტროლი.
მეცნიერების მოსაზრებები
ვოქსზოგო შემდეგი მექანიზმით მუშაობს: ის უერთდება B-ტიპის ნატრიურეზულ პეპტიდს, რომელიც ზრდის მარეგულირებელი გენის აქტიურობას ამცირებს და ამით ძვლის ზრდას ასტიმულირებს.
“წამალი, რა თქმა უნდა, ვერ აღადგენს შეუქცევად ნაკლოვანებებს და ზრდას სრულად ვერ უზრუნველყოფს, თუმცა, საკმაოდ მნიშვნელოვნად ასტიმულირებს [ზრდის] პროცესს,” - უთხრა ექიმმა ერიკ რუშმა “ნიურ იორკ თაიმზს”. ერიკ რუში კანზასის ბავშვთა ჰოსპიტლის კლინიკური გენეტიკოსია, ასევე მისურის უნივერსიტეტის ასოცირებული პროფესორი.
ერიკ რუში ვოზორიტიდის კლინიკურ გამოცდაში ჩართული არ იყო, თუმცა, მწარმოებელი კომპანია BioMarin-ის კონსულტანტი გახლდათ და ჩართულია მსგავსი წამლების კლინიკურ კვლევებში.
ექიმ რავი სავარირაიანის თქმით, ვოზორიტიდი შეიცავს და მთავარ იარაღად იყენებს ცილის სინთეტურ, ხელოვნურად მიღებულ ფორმას, რომელსაც ადამიანის ორგანიზმი ისედაც - ბუნებრივად - გამოიმუშავებს. მისი თქმით, ვოზორიტიდი იმ ზედმეტად აქტიურ გენს უმიზნებს, რომელიც ძვლის ზრდას უშლის ხელს, ასუსტებს გენის მუშაობას და ამ მექანიზმით, ძვლის ზრდას ასტიმულირებს. რავი სავარირაიანი ავსტრალიაში, მელბურნის მერდოკის ბავშვთა კვლევის ისნტიტუტის კლინიკური გენეტიკოსია.
რავი სავარირაიანი ვოზორიტიდზე კლინიკური კვლევის ხელმძღვანელიც იყო.მან ვოზორიტიდის მოქმედება ადამიანის ჯანმრთელობის მდგომარეობაზე მცენარის მორწყვას შეადარა.
“თუ მცენარეს ბევრ წყალს დავუსხამთ, ის კი არ გაიზრდება - დალპება. წყლის რაოდენობა უნდა ვარეგულიროთ,” - უთხრა მან “ნიუ იორკ თაიმზს” და ამ წამალს “ზუსტი თერაპია უწოდა, რომელიც არასასურველ ფონურ მდგომარეობას შეძლებისდაგვარად ასწორებს.”
“მაგალითად, გვყავს 12-13 წლის გოგონა, რომელმაც მკურნალობის შემდეგ, პირველად შეძლო საკუთარი ჰიგიენისთვის დამოუკიდებლად მიეხედა, რადგან მისი მკლავები უფრო დაგრძელდა,” - თქვა მან.
დამთავრებული კვლევები “ვოქსზოგოზე”
ამჟამად “ვოქსზოგოზე” 3 ინტერვენციული კლინიკური კვლევაა დასრულებული და მათი შედეგები გამოქვეყნებულია სხვადასხვა სამეცნიერო ჟურნალებში.
ესენია:
-
ინტერვენციული, ღია, ტიპის კვლევა, სადაც 35 პაციენტი იღებდა მონაწილეობას და მოწმდებოდა დოზა და წამლის უსაფრთხოება.[დაბეჭდილი აკადემიური სტატიები - Pharmacokinetics and Exposure-Response of Vosoritide in Children with Achondroplasia და C-Type Natriuretic Peptide Analogue Therapy in Children with Achondroplasia
-
ინტერვენციული, რენდიმიზებული, სამმაგად ბრმა, პლაცებოთი გაკონტროლებული, მესამე ფაზის კვლევა, სადაც 121 მონაწილე იყო ჩართული. ჩართვის კრიტერიუმები იყო აქონდროპლაზია, გენეტიკურად დადასტურებული. პაციენტებს დღეში 5 მკგ ერთ კილოგრამზე ვოქსზოგოს, სულ მცირე, 6 თვის განმავლობაში. კომპანიამ ეს მონაცემები წარუდგინა F.D.A.-ს და მასზე დაყრდნობით დამტკიცდა ვოქსზოგო, დაჩქარებული წესით ა.შ.შ.-ში;
-
მულტიცენტრული, მულტინაციონალური კლინიკური კვლევა აქონდროპლაზიის მქონე პედიატრიულ პაციენტებში, სადაც 363, 5 წლიდან 17 წლამდე პაციენტი იყო ჩართული.ამ კვლევის ფარგლებში დაზუსტდა დოზა [15 მკგ ერთ კილოგრამზე].
აქონდროპლაზიის სამკურნალოდ “ვოქსზოგოს” გამოცდა გრძელდება. მათი ნაწილი ამ კვლევების გაგრძელება-სრულყოფას ემსახურება, ნაწილი კი - სხვა დიზაინისაა და სხვა სამიზნეები აქვს [end points].
მიმდინარე კვლევების ნაწილი:
-
An Extension Study to Evaluate the Efficacy and Safety of BMN 111 in Children With Achondroplasia
-
A Clinical Trial to Evaluate Safety of Vosoritide in At-risk Infants With Achondroplasia
როგორი პაციენტები არ ჩართეს კვლევებში?
უცნობია, შეიძლება თუ არა ჯანმრთელობის ამ მდგომარეობის მქონე ბავშვების მკურნალობა “ვოქსზოგოთი”, რომელიც ქვემოთ არის ჩამოთვლილი: ჩატარებული ინტერვენციული კლინიკური კვლევები ამ კითხვაზე პასუხს არ იძლევა.
ესენია ბავშვები, რომლებიც მკვლევრებმა არ არ ჩართეს [clinical trial exclusion criteria] მათ კვლევებში, რადგან მათზე ამ წამლის გამოცდა იძლეოდა დამატებით რისკებს, რაზეც მათ პასუხისმგებლობა არ აიღეს.
ესენი არიან ბავშვები, რომლებსაც ჰქონდათ შემდეგი ჯანმრთელობის მდგომარეობები:
-
ჰიპოქონდროპლაზია
შემდეგი აშლილობები:
-
ჰიპოთირეოზი
-
ისეთი ტიპის დიაბეტი, რომლის დროსაც საჭიროა ინსულინი;
-
აუტოიმუნური ანთებითი დაავადება;
-
აუტოიმუნური ნაწლავის დაავადება;
-
აუტოიმუნირი ნეიროპათია;
-
აქვს ისეთი არასტაბილური ჯანმრთელობის მდგომარეობები, რომლებმაც შეიძლება ჩარევა დასჭირდეს კლინიკური კვლევის პერიოდში;
-
ზრდის ფირფიტები შერწყმულია.
ჰქონდა შემდეგი ანამზენი/ჯანმრთელობის ისტორია:
-
თირკმლის უკმარისობა;
-
ანემია.
გულ-სისხლძარღვთა ისეთი დაავადებები, როგორებიცაა:
-
გულის დისფუნქცია [პათოლოგიური ექოკარდიოგრამა [ECHO] მარცხენა პარკუჭის [LV] მასის ჩათვლით];
-
ჰიპერტროფიული კარდიომიოპათია;
-
გულის მანკები;
-
ცერებროვასკულური დაავადება, აორტის უკმარისობა;
-
კლინიკურად მნიშვნელოვანი პარკუჭზედა/პარკუჭოვანი პაროქსიზმული არითმია;
-
მიმდინარე მკურნალობები ისეთი ანტიჰიპერტენზიული მედიკამენტებით, როგორებიცაა: ანგიოტენზინ-გარდამქმნელი ფერმენტის ინჰიბიტორები, ანგიოტენზინ II რეცეპტორების ბლოკატორები, დიურეზულები, ბეტა-ბლოკატორები, კალციუმის არხის ბლოკატორები, გულის გლიკოზიდები, სისტემური ანტიქოლინერგული საშუალებები, ნებისმიერი მედიკამენტი, რომელმაც შეიძლება დაარღვიოს ან გააძლიეროს ცნობილი რეკომენსირებული ტაქიკარდიის ფუნქცია, რომელიც სავარაუდოდ გაგრძელდება კვლევის ხანგრძლივობის განმავლობაში;
-
მკურნალობდნენ ზრდის ჰორმონით, ინსულინის მსგავსი ზრდის ფაქტორით 1 [IGF-1] ან ანაბოლური სტეროიდებით წინა 6 თვის განმავლობაში ან გრძელვადიანად [3 თვეზე მეტი] ხნის განმავლობაში;
-
რეგულარულად ან ხანგრძლივი მკურნალობნენ [> 1 თვე] ორალური კორტიკოსტეროიდებით [დაბალი დოზით მიმდინარე ინჰალირებული სტეროიდი ასთმისთვის];
-
იყვნენ ჩართულები სხვა კვლევაში ან რომელიმე სამედიცინო საშუალების გამოცდაში, რომლიც აქონდროპლაზიას ან სხეულის მოკლე აღნაგობას მკურნალობს;
-
კვლევის დროს დასჭირდებათ ძვალთან დაკავშირებული ქირურგიული ჩარევები.
-
აქვს ჯანმრთელობის ისეთი მდგომარეობა, რომლის გამოც, მთავარი მკვლევრის აზრით, პაციენტი ვერ შეძლებს კლინიკურ კვლევაში სრულფასოვან მონაწილეობას და ვერ დაასრულებს მას ჯეროვნად;
-
თანმხლები დაავადება ან მდგომარეობა, რომელიც, მკვლევარის აზრით, ხელს უშლის ინდივიდს კვლევაში მონაწილეობას.
F.D.A.-ის ინტეგრირებული შეფასება “ვოქსზოგოზე”
დაშვების დღეს გამოქვეყნებული მცირე განცხადების გარდა, F.D.A.-ს ვებ-გვერზე გამოქვეყნებულია ინტეგრირებული, 289-გვერდიანი ანგარიში, სადაც 35 ავტორი “ვოქსზოგოზე” 4 კლინიკურ კვლევას დეტალურად განიხილავს.
35 რევიურს სხვადასხვა როლი აქვს კლინიკური სამიზნეების შესრულების შეფასებისას და დეტალურად აქვთ განხილული ოთხივე კვლევის როგორც უსაფრთხოება, ასევე ეფექტურობა [კვლევის ნომრები - 111-301, 111-302, 111-202-205 და 111-206].
F.D.A.-ის ინტეგრირებული შეფასების რევიუერების აზრით, უსაფრთხოების საკითხი მოიცავს საკითხებსა და შენიშვნებს, რომელთაც, დროთა განმავლობაში, შესაძლოა, ან გააუმჯობესონ ან გააუარესონ პაციენტის მდგომარეობა, რაც ინდივიდუალურიცაა და ხშირად ბოლომდე პროგნოზირებადი არ არის, ასევე დამოკიდებულია პაციენტის სხვა თანმხლებ დაავადებებსა და მდგომარეობებზე.
უსაფრთხოების მთავარი საკითხებია: სისხლის წნევის ვარდნა, ნევროლოგიური გართულებები, ძვლის დეფორმაციები, ძილის აფნოე. ექსპერტების დასკვნით, ეს ანოტაციაში აუცილებლად უნდა იყოს მითითებული და ამით დარეგულირდეს/მიეწოდოს პაციენტს ინფორმაცია, რომ მან/მშობელმა ინფორმირებული გადაწყვეტილება მიიღოს.
შეფასების ავტორები ასევე თვლიან, რომ ამ კვლევების ფარგლებში მწირი მონაცემები არსებობს აქონდროპლაზიის მქონე ისეთ პაციენტებზე, რომლებსაც თანმხლებ დაავადებად აქვთ ზომიერი და საშუალო დონის თირკმლის უკმარისობა. მეცნიერების აზრით, პაციენტებისთვის, რომლებსაც გლომერულარული ფილტრაციის სიჩქარე [რომელიც თირკმლის მუშაობას აფასებს] 60-ზე ნაკლები აქვთ [eGFR <60 mL/min/1.73 m2], ამ წამლის მიღება რეკომენდებული არ არის.
ავტორების აზრით, ასევე არის რისკი ძვლის ზრდის დაჩქარების, რომელმაც, შესაძლოა, ეპიფიზური ფირფიტა დროზე ადრე დახუროს და ძვლის ზრდის მასტიმულირებელი პროცესები შეზღუდოს ან/და დროზე ადრე შეაჩეროს.
ავტორების აზრით, ხსენებულ კლინიკურ კვლევებში ასევე არ არის ინფორმაცია, თუ რა გავლენა აქვს ვოზორიტიდს ორსულებზე, ნაყოფის დეფექტების განვითარების, მუცლის მოშლის და დედას-ჩვილთან დაკავშირებული სხვა არასასურველ გვერდით მოვლენების შესახებ.
ოთხივე კლინიკური კვლევის დროს კვლევიდან გამოთიშვის [dropout] მაჩვენებელი დაბალი იყო და სიკვდილის არც ერთი შემთხვევა არ ყოფილა.
ახალი კვლევა Voxzogo-ზე
Voxzogo-ზე ერთ-ერთი ახალი დასრულებული კვლევა მიმდინარე წელს გამოქვეყნდა რეცენზირებად ჟურნალ Genetics in Medicine-ში.
კვლევის შედეგების მიხედვით, ვოზორიტიდის მიღება 3.5 წლიდან 5-18 წლის ასაკის ბავშვებსა და მოზარდებს ზრდაში ეხმარება. რაც შეეხება უსაფრთხოებას: წამლის ხანგრძლივვადიანი უსაფრთხოების პროფილი დადებითია, მნიშვნელოვანი გვერდითი მოვლენის გარეშე.
კვლევის ფარგლებში არ მომხდარა სხეულის პროპორციების, ძვალში მინერალების სიმჭიდროვის შემცირება და ხერხემლის გამრუდება.
Voxzogo ევროკავშირში
ევროპის სამედიცინო მარეგულირებლის - ევროპის წამლის სააგენტოს [European Medicine Agency, EMA] “ვოქსზოგო” ევროკავშირის ქვეყნებისთვის 2021 წლის 26 აგვისტოდან აქვს დაშვებული.
E.M.A. და F.D.A.-ს ასაკობრივ მიდგომას შორის არის სხვაობა: E.M.A.-ს “ვოქსზოგოს” გამოყენება დაშვებული აქვს 2 წლის პაციენტებიდან, ხოლო F.D.A.-ს - 5 წლიდან.
რაც შეეხება უსაფრთხოების პროფილს: E.M.A.-ს ვებ-გვერდზე გამოქვეყნებული შეფასების დოკუმენტის მიხედვით, არსებობს უსაფრთხოების გარკვეული პროფილი, მაგრამ მონაცემები არასრულია და ბოლომდე დამაკმაყოფილებელი არ არის.
დოკუმენტის მიხედვით, ჩატარებულ კლინიკურ კვლევებში საგანგაშოდ საშიში გვერდითი მოვლენები არ გამოჩენილა, - რომელიც მის სარგებელს გადასწონიდა, მაგრამ არაა გამორიცხული, ასეთი მოვლენები ხანგრძლივვადიანი მკურნალობის შემდეგ გამოვლინდეს.
“საჭიროა უფრო მძლავრი, ხანგძლივვადიანი მკურნალობის პერიოდი [13-18 წელი], რომ უსაფრთხოების პროფილი უფრო გამოიკვეთოს. ხანგრძლივვადიანი მიღების დროს შესაძლოა ისეთი გვერდითი მოვლენები გამოიკვეთოს, როგორებიცაა ძვლოვანი სისტემის დასუსტება - კიდურებისა და სახსრების ფუნქციის რღვევა, უარყოფითი იმუნოგენური პასუხი. ეს ინფორმაცია მიმდინარე კლინიკურ კვლევებში, დროის სიმცირის გამო, არ არსებობს და დამატებითი მონაცემები დროთა განმავლობაში მოგროვდება. მონაცემების [მცირე] ზომიდან გამომდინარე, იშვიათი და მოულოდნელი გვერდითი მოვლენების გამოჩენაც არაა გამორიცხული,” - წერია E.M.A.-ს დოკუმენტში.
იქნება თუ არა მარტივი საქართველოსთვის ამ წამლის დამტკიცება, შესაბამისი გადაწყვეტილების შემთხვევაში?
საქართველოში Voxzogo ჯერ-ჯერობით დარეგისტრირებული არ არის. ქვეყანაში ფარმაცევტულ პროდუქტებს სამედიცინო და ფარმაცევტული საქმიანობის სააგენტო არეგისტრირებს.
როდესაც წამალი იმპორტირებულია და ის ისეთ გლობალურად მნიშვნელოვან მარეგულირებელს უკვე აქვს დამტკიცებული, როგორიც არის ა.შ.შ. სურსათისა და წამლის ადმინისტრაცია [F.D.A.], საქართველოსთვის მისი დარეგისტრირება და დამტიცება მხოლოდ ფორმალური დოკუმენტების შექმნას და დამტკიცებას გულისხმობს - საქართველოს ამ წამლის უსაფრთხოებისა და ეფექტურობის დასამტიცებლად დამატებით ხარჯების გაწევა არ მოუწევს, რადგან შესაძლებლობის ფარგლებში მოგროვებადი მონაცემები დიდ ევროპულ და ამერიკულ მარეგულირებლებს [F.D.A. და E.M.A.] უკვე მოგროვებული აქვთ.
ესენციური [სასიცოცხლოდ აუცილებელი] წამლების სია
ჯანდაცვის სამინისტროს აქვს ინოვაციური, ძვირადღირებული მედიკამენტების შესყიდვის მექანიზმი, ამ მექანიზმის შემუშავებაში სამინისტროს ჯანდაცვის მსოფლიო ორგანიზაცია და მსოფლიო ბანკი დაეხმარა.
მაგრამ თავად ვოსორიტიდი არ შედის ჯანდაცვის მსოფლიო ორგანიზაციის მიერ შემუშავებულ სასიცოცხლოდ აუცილებელი მედიკამენტების ჩამონათვალში, რომელშიც დაახლოებით 600-მდე მოლეკულა და მათი 124 თერაპიული ალტერნატივაა შეტანილი
ესენციური წამლების მიმდინარე სიის მომზადებისას, ვოსორიტიდს ავტორიზაცია არ ჰქონდა.
“პირობითი ავტორიზაციის ქონის შემთხვევაშიც კი, სიაში შეტანის საფუძველი ვერ გახდებოდა. - ამბობს თინა ტურძილაძე, ჯანდაცვის კონსულტანტი, რომელიც ამ დოკუმენტის შემუშავებაში იღებდა მონაწილეობას.
ჯანდაცვის მსოფლიო ორგანიზაცია “სასიცოცხლოდ აუცილებელი წამლების სიას” [WHO Model Lists of Essential Medicines] გეგმიურად განაახლებს 2023 წელს[სია ყოველ ორ წელში ერთხელ ახლდება], ტურძილაძის თქმით, შესაბამისად გადაიხედება და დამტკიცდება საქართველოს ჩამონათვალი.
“სიაში მოლეკულების შეტანა მკაცრად გაწერილი მეთოდოლოგიებით ხდება, აქ ემოციები და პოლიტიკური მიზანშეწონილობები კრიტერიუმები არ არის, მიუხედავად პიროვნული და ადამიანური ემპათიებისა, ეს არ შეიძლება აისახოს ამ კატეგორიის გადაწყვეტილებებზე, საჭიროა მაღალი ხარისხის მტკიცებულებები უსაფრთხოებაზე და ეფექტიანობაზე. ჯერ-ჯერობით ასეთი მტკიცებულებები არ არსებობს, რომლის ექსტრაპოლაციაც შესაძლებელია, ყველას გვაქვს და გვინდა გვქონდეს, პოზიტიური მოლოდინი მიმდინარე კვლევების ახალ მონაცემების, მათ შორის იმ თანმხლები დაავადებების მქონე სუბიექტების ჩართულობით კვლევების მონაცემებიც, რომლებიც ამ ეტაპამდე არ ჩართულან კვლევებში და პროგნოზიც რთულია. სპეციალისტების მოსაზრებები ძირითადად ოპტიმალური ვარაუდების ვერსიებია.”
ფარმ-კომპანიების კომერციული ინტერესი [თუ მისი ნაკლებობა]
რაკი ვოქსზოგო იშვიათი გენეტიკური მდგომარეობის სამკურნალო წამალია და პაციენტების რაოდენობა მცირეა, მასზე ფარმაცევტული კომპანიების დაინტერესება მაღალი არაა. ამჟამად მას მხოლოდ ერთი კომპანია აწარმოებს და მისი ფასი მაღალია.
ახალი წამლის წარმოების დროს ძალიან მნიშვნელოვანია კლინიკური კვლევის დაფინანსება, რომელსაც, ძირითადად, კომპანიები აკეთებენ. კლინიკური კვლევები, უმეტესად, წლების განმავლობაში იწელება და ხშირად მათი ღირებულება, საშუალოდ, მილიონობით დოლარია. ამასთან ერთად, კლინიკური კვლევის წარმატება გარანტირებული არ არის და კომპანიისთვის ამის გათვლა ცალკე რისკია.
როცა საქმე ეხება განსაკუთრებით იშვიათ დაავადებებს, ფარმაცევტული კომპანიებისთვის ასეთი რისკები კიდევ უფრო იზრდება: ჯერ პაციეტების კლინიკურ კვლევაში მოზიდვის, შესაბამისი კრიტერიუმის მიხედვით არჩევის და შემდეგ კი ძვირადღირებული წამლის გაყიდვის შანსები მცირდება.
ვოქსზოგო F.D.A.-ს 2021 წელს დამტკიცებული ინოვაციური წამლების სიაშია. კომპანია BioMarin-ს ამ წამალზე, როგორც ინოვაციურ მედიკამენტზე, პატენტ[ებ]ის უფლება აქვს. ყველაზე ადრე ერთ-ერთ პატენტს ეწურება ვადა - 2030 წელს, ხოლო ყველაზე გვიან - 2036 წელს.
თინა ტურძილაძის აზრით, არც ერთი კომერციული ფარმაცევტული კომპანია დაინტერესებული არ იქნება, რომ ის საქართველოში შემოიტანოს, პაციენტების სიმცირისა და წამლის სიძვირის გამო.
შესაბამისად, მისი თქმით, ერთადერთი, ვინც ეს უნდა გააკეთოს, საქართველოს მთავრობაა: მკურნალობის ღირებულება, თუკი ამ წამლის დარეგისტრირება და შემოტანა გადაწყდება, გადასახადების გადამხდელების ჯიბიდან უნდა დაფინანსდეს.
“ერთია სურვილები, მეორეა შესაძლებლობები და მესამეა პასუხისმგებლობა. პირველი და მთავარი პრობლემა წამლის უსაფრთხოების და ეფექტიანობის პროფილია, რომელიც არ არის საკმარისად დადასტურებული, და ამაზე პასუხისმგებლობის აღება ძალიან ძნელია, მით უფრო როცა შესანიშნავად ვიცით E.M.A.-ს მიერ გაცემული პირობითი ავტორიზაციის ბევრი წარუმატებელი მოლეკულა უახლოესი წარსულიდან. მეორეს მხრივ, თუ მშობელი და ბავშვი ინფორმირებულია და თანახმაა, მაშინ მათ უნდა მიეცეთ ამ წამალზე მინიმუმ ფიზიკური ხელმისაწვდომობა და გარკვეული ფინანსური მხარდაჭერა, როგორც სახელმწიფოს, ისე საზოგადოების მხრიდან, ჩემი აზრით ეს სამართლიანი იქნება,” - უთხრა “პუბლიკას” ტურძილაძემ.
სამინისტროს პოზიცია
მას მერე, რაც მშობლების პროტესტმა ეროვნული მასშტაბი მიიღო და ყველა მედია-საშუალებამ გააშუქა, საქართველოს დევნილთა, შრომის, ჯანმრთელობისა და სოციალური დაცვის სამინისტრო მზადაა, შეიმუშავოს პროტოკოლი და მშობლებიც კი ჩართოს იშვიათი დაავადებების საკითხებზე მომუშავე საკოორდინაციო საბჭოს მუშაობაში და დააფინანსოს წამლის მკურნალობის ხარჯები.
მკურნალობის ხარჯები ჯერ სამინისტროს დათვლილი არ აქვს.
იშვიათი დაავადებების საკითხებზე მომუშავე საკოორდინაციო საბჭოს შეხვედრა მიმდინარე წლის 26 აპრილს გაიმართა. საბჭოს წევრებმა, იშვიათი დაავადებების მართვის საკითხებზე, გაიდლაინებისა და პროტოკოლების შემუშავების მექანიზმებზე და ამ პროცესში საერთაშორისო ექსპერტების ჩართვაზეე ისაუბრეს.
შეხვედრაზე აქონდროპლაზიის სამკურნალო მედიკამენტ “ვოსორიტიდთან” დაკავშირებით აღინიშნა, რომ არსებული არასაკმარისი მტკიცებულებების გამო, მსოფლიოს განვითარებული ქვეყნები ფრთხილად ეკიდებიან საკითხს, რათა მაქსიმალურად გარანტირებული იყოს პაციენტის უსაფრთხოება.
“პუბლიკას” სამინისტროში ვერ დაუდასტურეს იმის სავარაუდო თარიღი მაინც, როდის დამთავრდება ეროვნულ სახელმძღვანელო პროტოკოლზე მუშაობა, აქონდროპლაზიის მკურნალობასთან დაკავშირებით.
29 აპრილს დევნილთა, შრომის, ჯანმრთელობისა და სოციალური დაცვის მინისტრის მოადგილემ, თამარ გაბუნიამ, რომელიც ასევე არის საქართველოს დაავადებათა კონტროლისა და საზოგადოებრივი ჯანმრთელობის ეროვნული ცენტრის [NCDC] დირექტორის მოვალეობის შემსრულებელი, აღნიშნა, რომ “უწყება განაგრძობს კომუნიკაციას მედიკამენტ „ვოსორიტიდის“ მწარმოებელ კომპანისთან, რათა პროტოკოლისა და მართვის მექანიზმების შემუშავებისთანავე, მოხდეს ბავშვებისათვის ყველა საჭირო პროცედურის უზრუნველყოფა.“
განცხადებაში არ არის აღნიშნული, როდის დაიწყო ამ მოლაპარაკების პროცესი.
“პუბლიკამ” არაერთხელ გადაამოწმა ეს ინფორმაცია სამინისტროში, თუმცა, უწყებაში კონკრეტული თარიღი არ დაასახელეს.
კითხვები "ბიომარინთან"
მინისტრის მოადგილის განცხადებისა და შესაძლო მოლაპარაკების, ასევე ფასების შესახებ “პუბლიკამ” ინფორმაცია მწარმოებელ კომპანია BioMarin-თან გადაამოწმა.
“VOXZOGO® [vosoritide] ევროპის სამედიცინო სააგენტომ და ა.შ.შ. სურსათისა და წამლის ადმინისტრაციამ 2021 წელს დაამტკიცეს, და მას შემდეგ ის არაერთმა ქვეყანამ დანერგა და დაამტკიცა საკუთარ ქვეყანაში, გლობალურად. კომპანია BioMarin მზადაა, მედიკამენტები გაუნაწილოს მთელი მსოფლიოს პაციენტებს. ჩვენ ყველაფერს ვაკეთებთ, რომ წამალი ხელმისაწვდომი იყოს ისეთი პაციენტებისთვის, რომლებიც მისგან სარგებელს მიიღებენ,” - აღნიშნულია წერილში, სადაც “პუბლიკას” უპასუხეს.
“პუბლიკას” მეტი კითხვა ჰქონდა იმასთან დაკავშირებით, ნამდვილად დაიწყო თუ არა საქართველოს მთავრობამ მათთან მოლაპარაკება წამლის შესყიდვაზე და ასეთის შემთხვევაში, როდის.
კითხვები გვქონდა წამლის შესაძლო ფასებზე, ასევე იმაზე, იქნებოდა თუ არა შესაძლებელი სპეციალური [დაბალი] ფასები საშუალო შემოსავლის მქონე ქვეყნებისთვის ან გაუკეთებია თუ არა შეღავათიანი ფასების პროექტები კომპანიას რომელიმე სხვა, საქართველოს მსგავსი შემოსავლის, მქონე ქვეყანაში/ქვეყნისთვის.
BioMarin-მა “პუბლიკას” ამ კითხვებს არ უპასუხა.
რამდენიმე რჩევა კლინიკურ მართვაზე
იაპონელი მეცნიერების რჩევები აქონდროპლაზიის კლინიკური მართვის ჯერ კიდევ 2020 წელს, როცა აქონდროპლაზიის სამკურნალი წამალი დაშვებული არ იყო, 9 იაპონელმა მეცნიერმა დაწერა მაღალი დონის აკადემიური ნაშრომი - კლინიკური მართვის მეტა-ანალიზი, რომელსაც 79 აკადემიური წყარო ახლავს.
სისტემურ ანალიზში მოცემულია სრულყოფილი დიანოსტიკის [როგორც ძვლოვანი სისტემის ვიზუალიზების, ასევე სხვა ხერხები], აქონდროპლაზიის ყველა პოტენციური გართულებისა თუ თანხმლები დაავადებების აღწერები, მართვის გზები და შესაბამისი რჩევები, რაც, მათი თქმით, ექიმებსა და ქვეყნებს ჯანმრთელობის ამ მდგომარეობის მართვასა და ეროვნული პროტოკოლების შედგენაში დაეხმარებათ.
ამერიკის პედიატრიის აკადემიის რჩევები, რომელიც ასევე 2020 წლის ივნისში გამოქვეყნდა, იხილეთ აქ.
♦ ეს სტატია თავდაპირველად ონლაინ-გამოცემა "პუბლიკის" ვებ-გვერდზე გამოქვეყნდა, ამავე გამოცემის დაკვეთით.